| Dagli esperimenti di Rutherford abbiamo visto che un atomo può essere visto come un oggetto costituito da un nucleo contenente la carica positiva schermato nello spazio circostante dagli elettroni di carica negativa. L'atomo globalmente è neutro in quanto la somma delle cariche positive è contobilanciata dalla somma delle cariche negative. In prima approssimazione è risultato utile considerare l'atomo come un sistema planetario in cui il nucleo si comporta come il sole e gli elettroni come i pianeti. Dal modello planetario all'atomo di BohrUn elettrone ruota attorno ad un atomo come un pianeta attorno al sole. Nel caso più semplice di un elettrone che ruota attorno al nucleo di moto circolare uniforme, si osserva che l'elettrone è in grado di rimanere in orbita attorno al nucleo solo se la forza centripeta risulta essere controbilanciata dalla forza centrifuga dovuta allo stesso moto circolare uniforme. Forza centripeta = Forza elettrostatica = K e2 / R2 Forza centrifuga = m V2 / R In queste condizioni esso potrebbe stazionare a qualsiasi distanza dal nucleo, ma questo contrasta sia con quanto previsto dalla teoria sia dagli eventi sperimentali.
Bohr e la quantizzazione del momento angolare Per superare quanto sopra contestato, Bohr ha ipotizzato che, per motivi non meglio precisati, un elettrone può permanere indefinitamente solo su orbite che rispettano le seguenti condizioni:
Imponendo tali condizioni si ricava: K e2 / R2 = m V2 / R K e2 = m V2 R m K e2 R = ( m V R)2 = (nh)2 R= n2 [ h2 / (m K e2)] = n2 R0 essendo i termini racchiusi tra le parentesi quadre tutti associati a costanti si ricava che il raggio ossia la distanza dal nucleo in cui si può trovare un elettrone risulta essere proporzionale a n ( numero appartenente a N) al quadrato. L'energia totale di tale elettrone è pari alla metà dell'energia potenziale e quindi: E(n)= - 1/2 K e2 / R = - 1/n2 [ 1/2 m K2 e4 / h2] ossia inversamente proporzionale all'inverso del quadrato di n. L'energia rilasciata da un elettrone che passa da un livello n2 a un livello n1 con la creazione di un fotone di energia hn = E(n2) -E(n1) ossia: n = RH ( 1/n12 -1/n22) si osserva sperimentalmente quando consideriamo l'atomo di idrogeno. 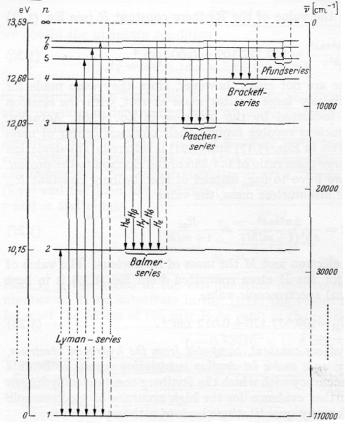
Non esistono limiti e pertanto si possono prevedere livelli a distanza infinita dal nucleo (considerando n tendente all'infinito). Pertanto quanto ricavato vale solo per i gas. Cosa accade se vogliamo applicare quanto ricavato ad una sostanza contenente numerosissimi atomi a distanze reciproche dell'ordine dei 10-10 metri? |
